發布時間:2025-06-04 來源:廣東省醫療器械管理學會 作者:天之恒
中國臺灣行政院衛生署食品藥品管理局(衛生福利部食品藥物管理署Taiwan Food and Drug Administration,簡稱TFDA)負責臺灣的醫療器械產品注冊;臺灣醫療器械注冊需要遵循如下法規要求:
◆ 《醫療器材管理法》
◆ 《醫療器材管理法施行細則》
◆ 《醫療器材分類分級管理辦法》
◆ 《醫療器材品質管理系統檢查及制造許可核發辦法》
◆ 《醫療器材許可證核發與登錄及年度申報準則》
注冊周期及費用
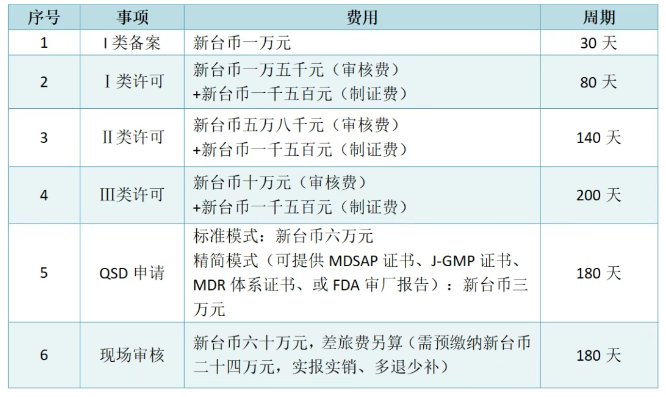
注:如涉及臨床試驗資料審核,費用另計;其中臨床試驗方案-新臺幣五萬元,臨床試驗報告-新臺幣五萬元,臨床試驗文件技術性評估-新臺幣兩萬元,臨床試驗變更審查-新臺幣五千元,海外臨床試驗機構現場核查-新臺幣六十五萬元。





